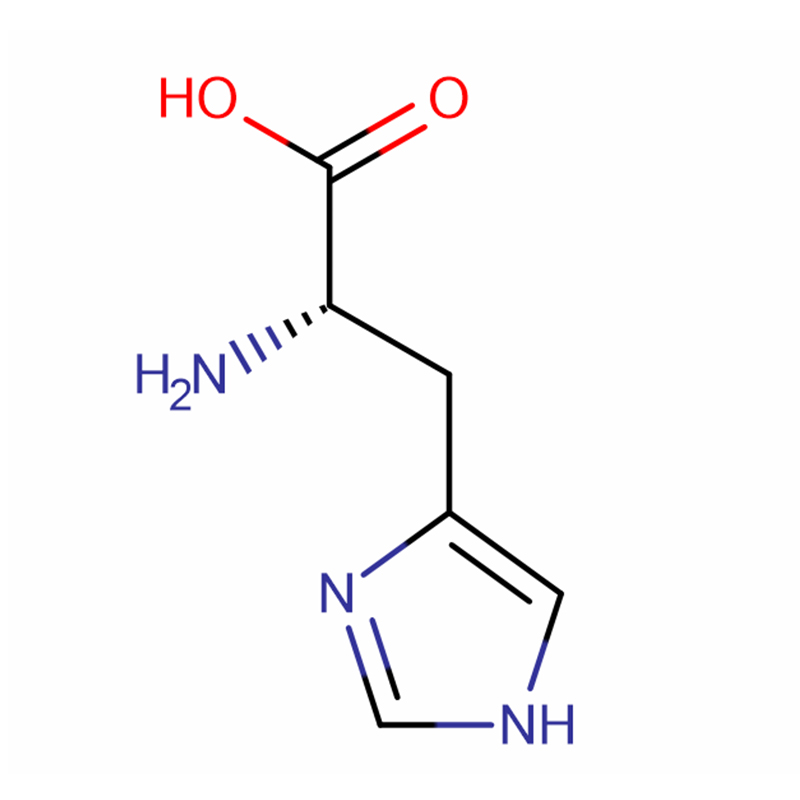
L-Histidina Cas: 71-00-1 98,5% Cristais brancos ou pó cristalino
| Número de catálogo | XD90301 |
| Nome do Produto | L-Histidina |
| CAS | 71-00-1 |
| Fórmula molecular | C6H9N3O2 |
| Peso molecular | 155,15 |
| Detalhes de armazenamento | Ambiente |
| Código Tarifário Harmonizado | 29332990 |
Especificação do produto
| Ensaio | 98,5% min |
| Aparência | Cristais brancos ou pó cristalino |
| Nota | USP39 |
| Rotação específica | +12,6° a +14,0° |
| Identificação | Absorção infravermelha |
| pH | 7,0 - 8,5 |
| SO4 | <=0,03% |
| Fe | <=30 ppm |
| Perda ao secar | <=0,2% |
| Resíduo na Ignição | <=0,1% |
| Cl | <=0,05% |
| Metais pesados (PB) | <=15 ppm |
| compostos relacionados | Não é encontrado mais de 0,5% de qualquer impureza individual;Não mais de 2,0% do total de impurezas é encontrado |
As sequências ricas em G formadoras de quádruplos são distribuídas de forma desigual por todo o genoma humano.Seu enriquecimento em promotores oncogênicos e telômeros gerou interesse no direcionamento do G-quadruplex (GQ) para uma terapia anticancerígena.Aqui, apresentamos uma análise quantitativa das conformações e dinâmica das sequências formadoras de GQ medidas por fluorescência de molécula única.Além disso, relacionamos essas propriedades aos ligantes de direcionamento de GQ e à ligação da proteína G4 resolvase 1 (G4R1).Nosso resultado mostra que tanto o comprimento do loop (componentes não-G) quanto a sequência contribuem para a conformação do GQ.Traços de moléculas únicas em tempo real revelam que a dinâmica de dobramento também depende da composição do loop.Demonstramos que pequenas moléculas estabilizadoras de GQ, N-metil mesoporfirina IX (NMM), seu análogo, NMP e a proteína G4R1 ligam-se seletivamente à conformação GQ paralela.Nossas descobertas apontam para a complexidade do dobramento de GQ governado pelo comprimento e sequência do loop e como a conformação de GQ determina a propensão de ligação de moléculas pequenas e proteínas.