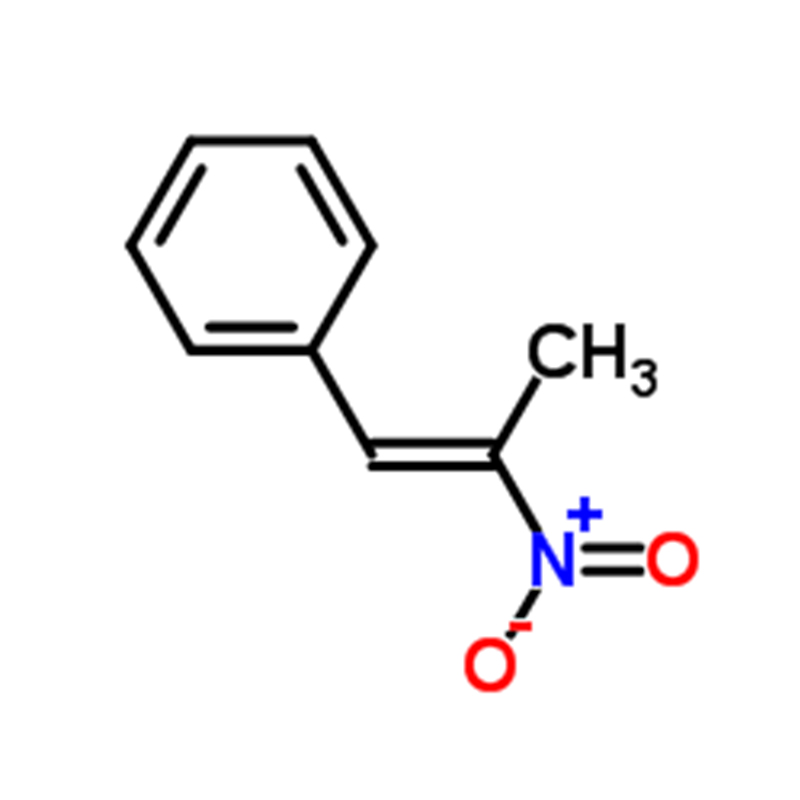
Dimetil amarelo CAS:60-11-7 Pó amarelo a laranja a marrom
| Número de catálogo | XD90467 |
| Nome do Produto | Dimetil amarelo |
| CAS | 60-11-7 |
| Fórmula molecular | C14H15N3 |
| Peso molecular | 225-29 |
| Detalhes de armazenamento | Ambiente |
| Código Tarifário Harmonizado | 29270000 |
Especificação do produto
| Ponto de fusão | 105-116 graus C |
| Aparência | Pó amarelo a laranja a marrom |
| Ensaio | 99% |
| Perda ao secar | <1,0% |
| Força | 98,67% |
| Mudança de cor | Vermelho @ pH 2,9, Amarelo @ pH 4,9 |
| cinzas sulfatadas | 0,4% |
| Lamda Max | 400 nm (em metanol) |
A topologia da membrana do domínio do canal E1 da colicina foi estudada por transferência de energia de ressonância de fluorescência (FRET).O FRET envolveu um aminoácido fluorescente geneticamente codificado (cumarina) como o doador e um resíduo de cisteína marcado seletivamente amarrado com DABMI (4-(dimetilamino)fenilazofenil-4'-maleimida) como o aceitador FRET.O resíduo de cumarina fluorescente foi incorporado à proteína por meio de um par ortogonal de tRNA/aminoacil-tRNA sintetase que permitiu a incorporação seletiva em qualquer local dentro do domínio do canal de colicina.Cada variante continha uma mutação stop (TAG) para incorporação de cumarina e uma mutação de cisteína (TGT) para ligação DABMI.Seis distâncias inter-helicoidais dentro das hélices 1-6 foram determinadas usando análise FRET para ambos os estados solúvel e ligado à membrana.Os dados FRET mostraram grandes mudanças nas distâncias inter-hélices entre as hélices 3-6 após a associação da membrana, fornecendo uma nova visão sobre a estrutura ligada à membrana do domínio do canal.Em geral, as eficiências inter-helicoidais da cumarina-DABMI FRET diminuíram após a ligação da membrana, com base no modelo guarda-chuva para o canal de colicina.Um modelo provisório para o estado fechado do domínio do canal foi desenvolvido com base nos dados FRET atuais e publicados anteriormente.O modelo sugere arranjo circular das hélices 1-7 no sentido horário a partir do lado extracelular e associação interfacial da membrana das hélices 1, 6, 7 e 10 em torno do hairpin transmembranar central formado pelas hélices 8 e 9.



![3,3',5,5'-Tetrametil-[1,1'-bifenil]-4,4'-diamina Cas:54827-17-7 99%](http://cdn.globalso.com/xdbiochems/54827-17-71.jpg)