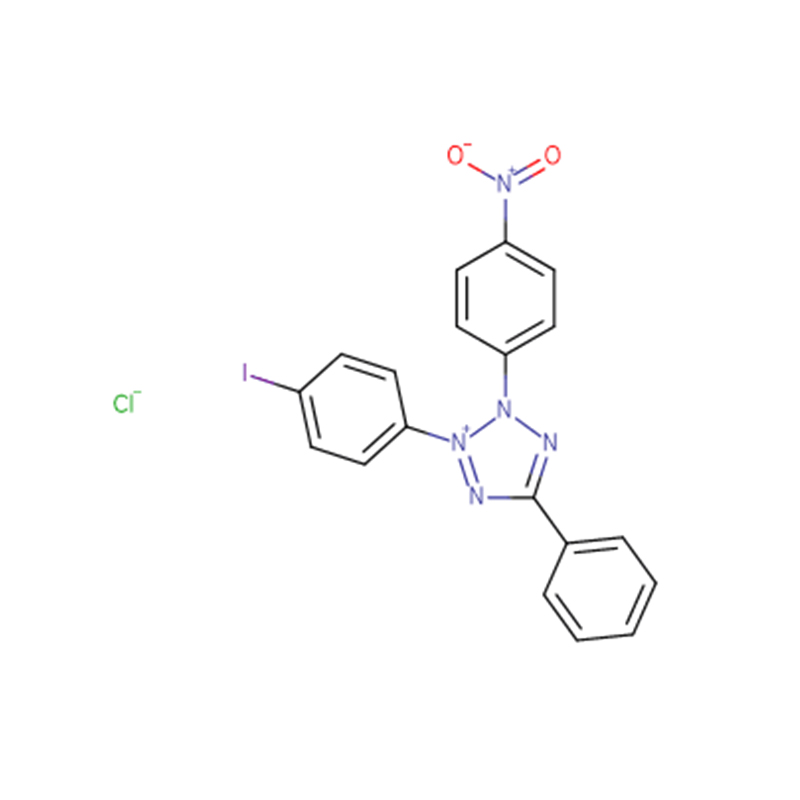
Cloreto de iodonitrotrazólio Cas: 146-68-9 98% Pó amarelo claro a laranja
| Número de catálogo | XD90217 |
| Nome do Produto | Cloreto de iodonitrotetrazólio |
| CAS | 146-68-9 |
| Fórmula molecular | C19H13ClIN5O2 |
| Peso molecular | 505,70 |
| Detalhes de armazenamento | 2 a 8°C |
| Código Tarifário Harmonizado | 32129000 |
Especificação do produto
| Identificação | H-RMN |
| Solubilidade | solução clara |
| Aparência | Pó amarelo claro a laranja |
| Ensaio HPLC | >98% |
Uma translocação recíproca do gene ABL1 para o gene BCR resulta na expressão da proteína de fusão oncogênica BCR-ABL1, que caracteriza a leucemia mieloide crônica humana (LMC), uma doença mieloproliferativa considerada invariavelmente fatal até a introdução da família imatinibe de tirosina quinase inibidores (TKI).No entanto, a insensibilidade das células-tronco da LMC ao tratamento com TKI e a resistência intrínseca ou adquirida ainda são causas frequentes de persistência da doença e progressão da fase blástica em pacientes após terapias iniciais bem-sucedidas.Aqui, investigamos um possível papel para a quinase MAPK15/ERK8 na autofagia dependente de BCR-ABL1, um processo chave para a leucemogênese induzida por oncogenes.Nesse contexto, mostramos a capacidade de MAPK15 em recrutar fisicamente o oncogene para vesículas autofágicas, confirmando nossa hipótese de um papel biologicamente relevante para essa MAP quinase na transdução de sinal por esse oncogene.De fato, modelando a sinalização de BCR-ABL1 em células HeLa e aproveitando um modelo fisiologicamente relevante para LMC humana, ou seja, células K562, demonstramos que a autofagia induzida por BCR-ABL1 é mediada por MAPK15 por meio de sua capacidade de interagir com a família LC3 proteínas, de maneira LIR-dependente.Curiosamente, também fomos capazes de interferir na autofagia induzida por BCR-ABL1 por uma abordagem farmacológica destinada a inibir MAPK15, abrindo a possibilidade de atuar sobre essa quinase para afetar a autofagia e doenças dependentes dessa função celular.De fato, para apoiar a viabilidade dessa abordagem, demonstramos que a depleção da expressão endógena de MAPK15 inibiu a proliferação celular dependente de BCR-ABL1, in vitro, e a formação de tumores, in vivo, fornecendo, portanto, uma nova ligação "medicável" entre BCR-ABL1 e LMC humana.