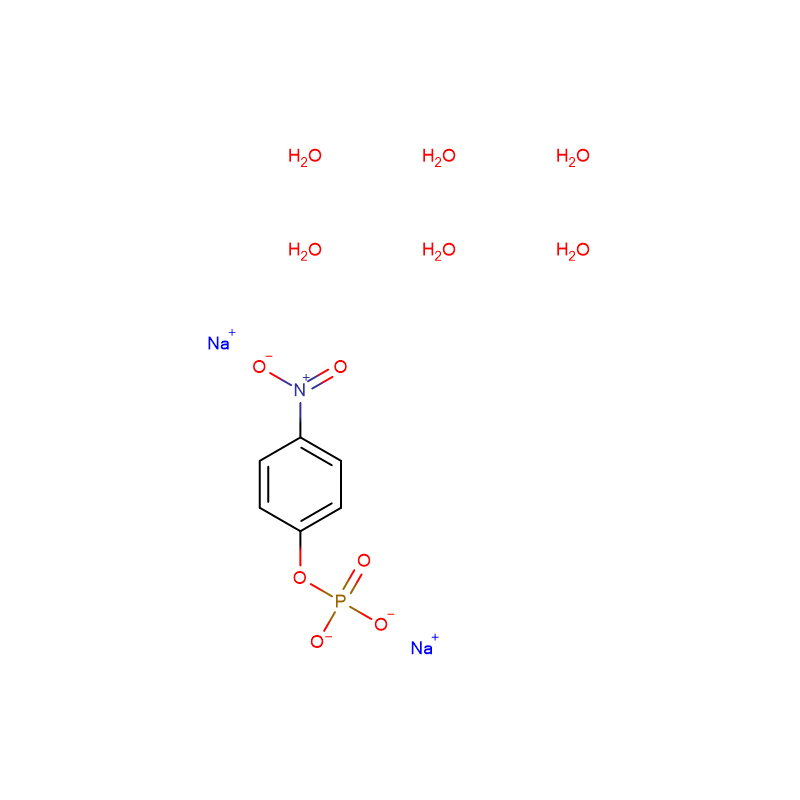
Sal dissódico de 4-nitrofenil fosfato 6-hidratado CAS:333338-18-4 pó branco a amarelo claro
| Número de catálogo | XD90511 |
| Nome do Produto | Sal dissódico de 4-nitrofenil fosfato 6-hidrato |
| CAS | 333338-18-4 |
| Fórmula molecular | C6H16NNa2O12P |
| Peso molecular | 371.142 |
| Detalhes de armazenamento | Ambiente |
| Código Tarifário Harmonizado | 29199000 |
Especificação do produto
| Aparência | branco a amarelo pálido |
| Ensaio | 99% |
Mais de 70% dos gliomas de baixo grau carregam uma mutação R132H heterozigótica no gene que codifica a isocitrato desidrogenase 1 (IDH1).Isso confere à enzima a nova capacidade de converter α-cetoglutarato em 2-hidroxiglutarato, levando à tumorigênese.A principal fonte de produção de 2-hidroxiglutarato é a glutamina, que, no câncer, também é uma fonte de anaplerose do ciclo do ácido tricarboxílico (TCA).Uma fonte alternativa de anaplerose é o fluxo de piruvato via piruvato carboxilase (PC), que é uma via comum em astrócitos normais.O objetivo deste estudo foi determinar se o PC serve como fonte de anaplerose TCA em células mutantes IDH1 em que a glutamina é usada para produção de 2-hidroxiglutarato.O fluxo de piruvato via PC e via piruvato desidrogenase (PDH) foi determinado usando espectroscopia de ressonância magnética para sondar a marcação de glutamato e glutamina conduzidos por ¹³C derivados de glicose.Ensaios de atividade, RT-PCR e western blotting foram usados para sondar a expressão e atividade de enzimas relevantes.Os dados do Cancer Genome Atlas (TCGA) foram analisados para avaliar a expressão de enzimas em amostras de glioma humano. Em comparação com as células do tipo selvagem, as células IDH1 mutantes aumentaram significativamente o fluxo fracionário através do PC.Isso foi associado a um aumento significativo na atividade e expressão de PC.Ao mesmo tempo, a atividade de PDH diminuiu significativamente, provavelmente mediada pelo aumento significativo da fosforilação inibitória de PDH pela quinase 3 de PDH. tipo IDH. Nossos achados sugerem que alterações no PC e PDH podem ser uma parte importante da adaptação celular à mutação IDH1 e podem servir como potenciais alvos terapêuticos.