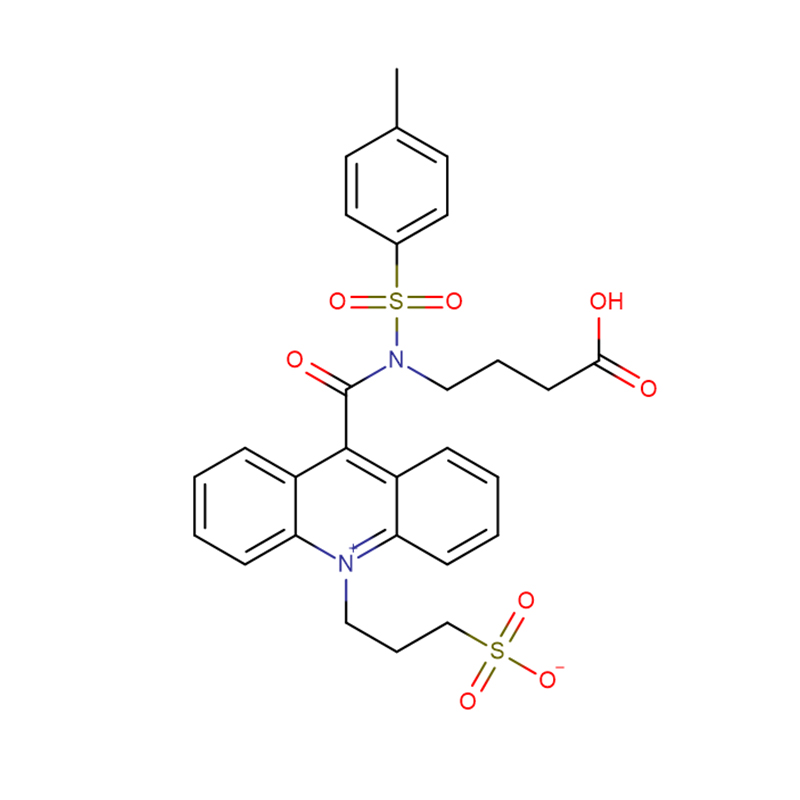
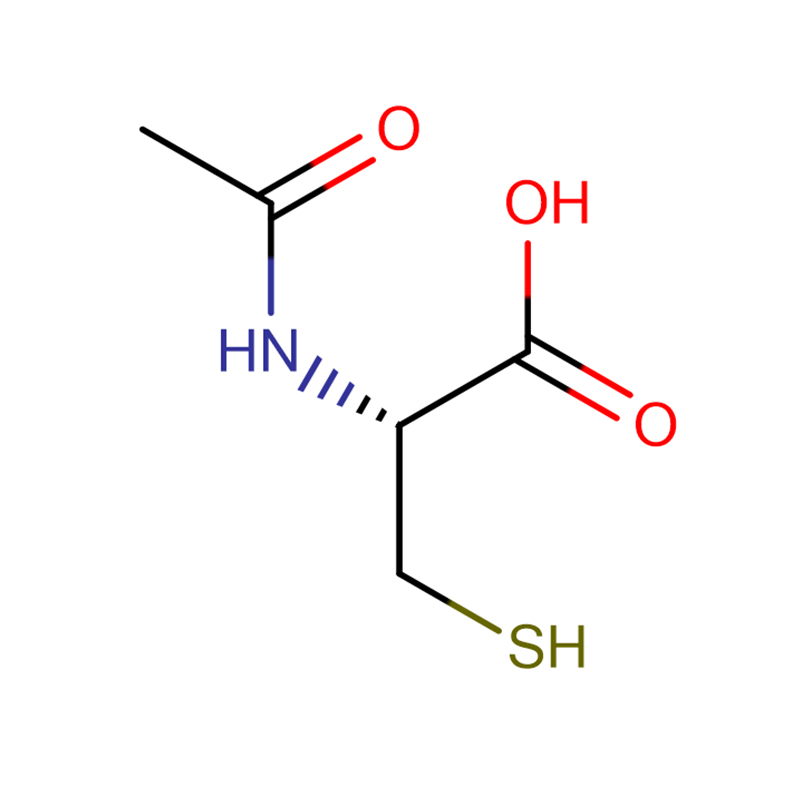
4-Amino-3-hidrazino-1,2,4-triazol-5-tiol Cas:28836-03-5 99% Amarelo a verde sólido
| Número de catálogo | XD90146 |
| Nome do Produto | 4-Amino-3-hidrazino-1,2,4-triazol-5-tiol |
| CAS | 28836-03-5 |
| Fórmula molecular | C16H13NO3S·NH3 |
| Peso molecular | 316,37 |
| Detalhes de armazenamento | Ambiente |
| Código Tarifário Harmonizado | 2923900090 |
Especificação do produto
| Aparência | Amarelo a verde sólido |
| Assay | ≥ 99% |
| Ponto de fusão | 237°C(dec.)(lit.) |
| Solubilidade | NaOH: solúvel1 N |
| Solúvel em água | Solúvel em água, NaOH 1N e metanol. |
1.Estudamos os efeitos inibitórios da isorhamnetina na tirosinase de cogumelos por cinética de inibição e simulação computacional.A isorhamnetina inibiu reversivelmente a tirosinase de forma mista em Ki=0,235±0,013 mM.Medições de fluorescência intrínseca e de ligação de 1-anilinonaftaleno-8-sulfonato (ANS) mostraram que a isorhamnetina não induziu alterações significativas na estrutura terciária da tirosinase.Para obter informações sobre o processo de inativação, a cinética foi calculada por meio de medições de intervalo de tempo e reações contínuas de substrato.Os resultados indicaram que a inativação induzida pela isorhamnetina foi uma reação de primeira ordem com processos bifásicos.Para obter mais informações, simulamos o acoplamento entre tirosinase e isorhamnetin.A simulação foi bem-sucedida (energias de ligação para Dock6.3: -32,58 kcal/mol, para AutoDock4.2: -5,66 kcal/mol e para Fred2.2: -48,86 kcal/mol), sugerindo que a isorhamnetina interage com vários resíduos, como como HIS244 e MET280.Essa estratégia de prever a interação da tirosinase em combinação com a cinética baseada em um composto de flavanona pode ser útil na triagem de potenciais inibidores naturais da tirosinase.
2. A via de desdobramento ácido da conalbumina (CA), uma glicoproteína monomérica da clara de ovo de galinha, foi investigada usando espectroscopia de CD de UV distante e próximo, emissão de fluorescência intrínseca, sonda de fluorescência extrínseca 1-anilino-8-naftaleno sulfonato (ANS) e dispersão de luz dinâmica (DLS).Observamos mudanças dependentes do pH na estrutura secundária e terciária do CA.Possui estrutura secundária α-helicoidal semelhante à nativa em pH 4,0, mas perde a estrutura em pH 3,0.O CA existia exclusivamente como um estado de glóbulo pré-fundido e estado de glóbulo fundido em solução a pH 4,0 e pH 3,0, respectivamente.O efeito do pH na conformação e termoestabilidade do CA aponta para sua resistência ao calor em pH neutro.Os resultados do DLS mostram que o estado MG existia como forma compacta em soluções aquosas com raios hidrodinâmicos de 4,7 nm.A extinção da fluorescência do triptofano pela acrilamida confirmou ainda a acumulação de um estado intermediário, parcialmente desdobrado, entre os estados nativo e desdobrado.


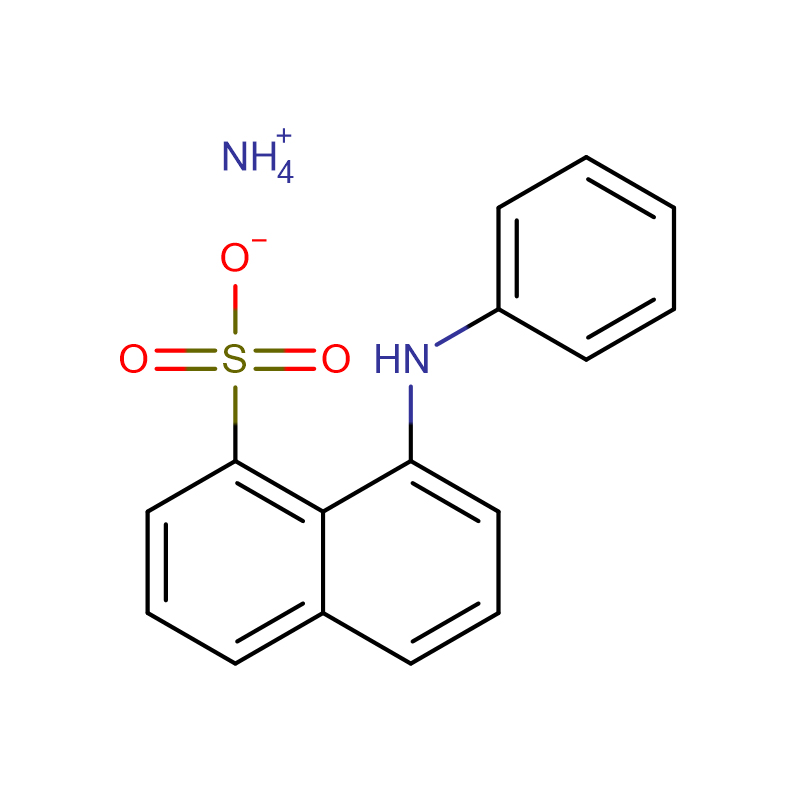


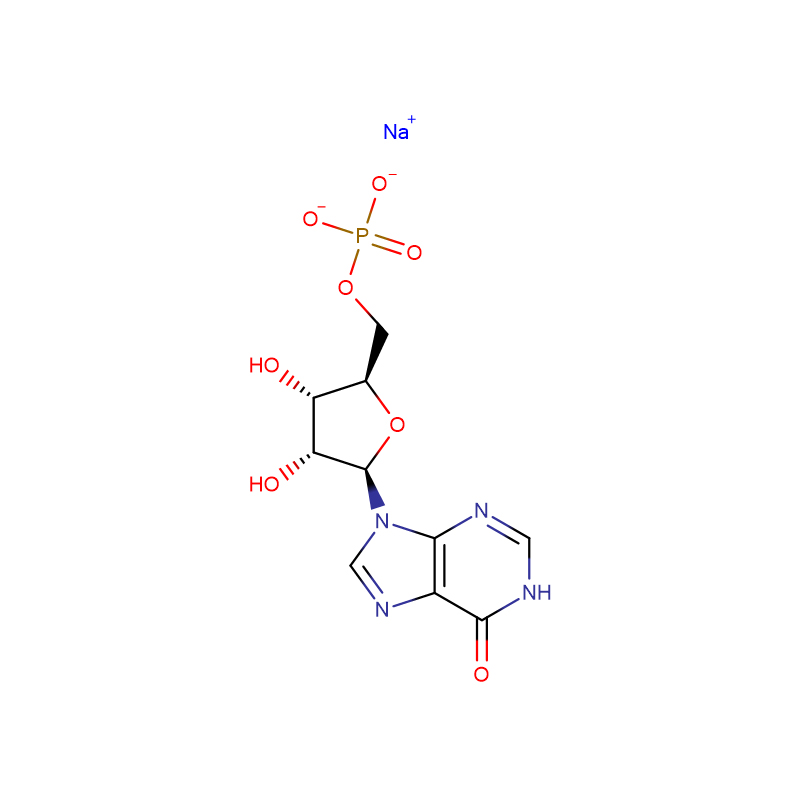
![Sal de sódio de N-[[bis[4-(dimetilamino)fenil]amino]carbonil] glicina Pó cristalino branco a verde-acinzentado](http://cdn.globalso.com/xdbiochems/115871-19-7.jpg)