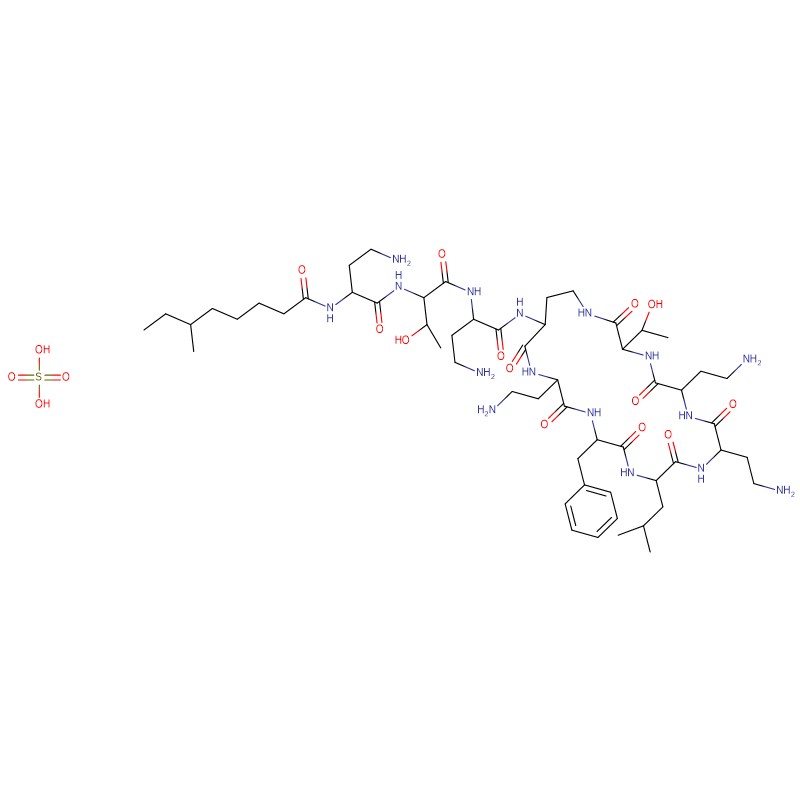
Sulfato de polimixina B CAS:1405-20-5 Pó branco
| Número de catálogo | XD90360 |
| Nome do Produto | Sulfato de Polimixina B |
| CAS | 1405-20-5 |
| Fórmula molecular | C55H96N16O13 · 2H2SO4 |
| Peso molecular | 1385,61 |
| Detalhes de armazenamento | 2 a 8°C |
| Código Tarifário Harmonizado | 29419000 |
Especificação do produto
| Conclusão | Em conformidade com USP35 |
| Metais pesados | <20ppm |
| pH | 5-7 |
| Identificação | Cromatografia líquida: conforme |
| Ensaio | 99% |
| Aparência | pó branco |
| Perda ao secar | <6% |
| Solubilidade | Livremente solúvel em água, ligeiramente solúvel em etanol |
| Sulfato | 15,5% - 17,5% |
| Tamanho da partícula | <30µm |
| Rotação óptica específica | -78° -90° |
| fenilalanina | 9,0%-12,0% |
| pirogênios | Atende aos requisitos |
| cinzas sulfatadas | <0,75% |
| Contagem aeróbica viável total | <100cfu/g |
| Potência | >6500 UI/mg |
A organela de secreção de proteína ExPortal em Streptococcus pyogenes é um microdomínio de membrana contendo fosfolipídios aniônicos enriquecido em translocons Sec e fatores de biogênese de proteínas pós-secreção.A polimixina B se liga e interrompe a integridade do ExPortal, resultando na secreção defeituosa de várias toxinas.Para obter informações sobre os fatores que influenciam a organização do ExPortal, uma triagem genética foi realizada para selecionar mutantes resistentes à polimixina B espontâneos que exibem integridade ExPortal aprimorada.O resequenciamento de todo o genoma de 25 mutantes resistentes revelou de uma a quatro mutações por genoma mutante agrupadas principalmente dentro de um conjunto central de 10 grupos de genes.A construção de mutantes com deleções ou inserções individuais demonstrou que 7 genes centrais conferem resistência e integridade ExPortal aprimorada por meio da perda de função, enquanto 3 foram provavelmente devidos ao ganho de função e/ou efeitos combinatórios.Os principais genes de resistência incluem um regulador transcricional da biossíntese lipídica, vários genes envolvidos na aquisição de nutrientes e uma variedade de genes envolvidos em respostas ao estresse.Dois membros da última classe também funcionam como novos reguladores da protease de cisteína SpeB secretada.A análise da mutação mais frequentemente isolada, uma única deleção de nucleotídeo em uma faixa de 9 resíduos consecutivos de adenina em pstS, codificando um componente de um transportador de Pi de alta afinidade, sugere que essa sequência funciona como um interruptor molecular para facilitar a adaptação ao estresse.Juntos, esses dados sugerem a existência de uma resposta de estresse de membrana que promove maior integridade ExPortal e resistência a peptídeos antimicrobianos catiônicos.