O IPTG (isopropil-β-D-tiogalactosídeo) é um análogo do substrato da β-galactosidase, altamente induzível.Sob a indução de IPTG, o indutor pode formar um complexo com a proteína repressora, de modo que a conformação da proteína repressora seja alterada, de modo que não possa ser combinada com o gene alvo, e o gene alvo seja expresso de forma eficiente.Então, como a concentração de IPTG deve ser determinada durante o experimento?Quanto maior é melhor?
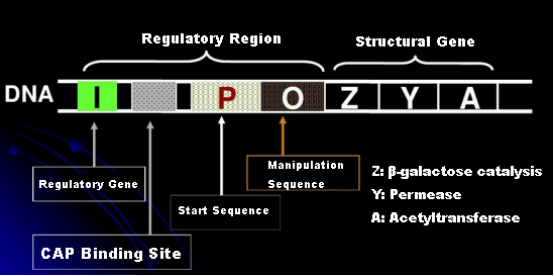
Primeiro, vamos entender o princípio da indução de IPTG: o operon lactose de E. coli (elemento) contém três genes estruturais, Z, Y e A, que codificam β-galactosidase, permease e acetiltransferase, respectivamente.lacZ hidrolisa a lactose em glicose e galactose, ou em alo-lactose;lacY permite que a lactose no ambiente passe pela membrana celular e entre na célula;lacA transfere o grupo acetil de acetil-CoA para β-galactosídeo, o que envolve a remoção do efeito tóxico.Além disso, existe uma sequência operacional O, uma sequência inicial P e um gene regulador I. O código do gene I é uma proteína repressora que pode se ligar à posição O da sequência operadora, de modo que o operon (meta) seja reprimido e desligado.Existe também um local de ligação para a proteína ativadora de genes catabólicos-local de ligação CAP a montante da sequência inicial P. A sequência P, a sequência O e o local de ligação CAP juntos constituem a região reguladora do operon lac.Os genes codificadores das três enzimas são regulados pela mesma região reguladora para alcançar a expressão coordenada dos produtos gênicos.
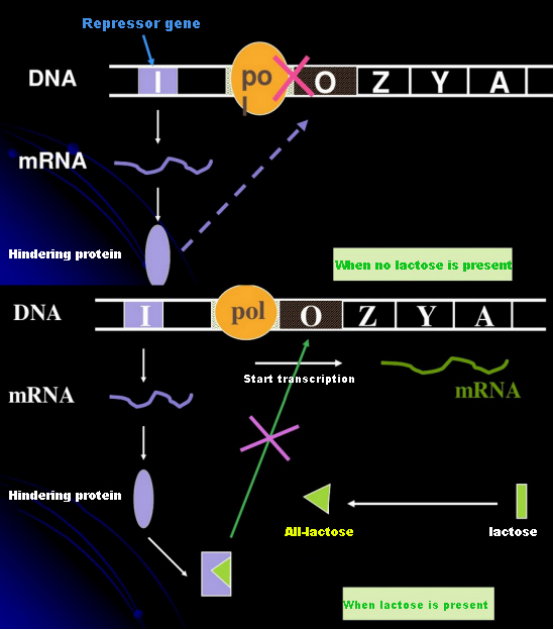
Na ausência de lactose, o operon lac (meta) está em estado de repressão.Neste momento, o repressor lac expresso pela sequência I sob o controle da sequência do promotor PI liga-se à sequência O, o que impede a ligação da RNA polimerase à sequência P e inibe o início da transcrição;quando a lactose está presente, o operon lac (meta) pode ser induzido. Nesse sistema de operon (meta), o verdadeiro indutor não é a própria lactose.A lactose entra na célula e é catalisada pela β-galactosidase para ser convertida em alolactose.Esta última, como molécula indutora, liga-se à proteína repressora e altera a conformação da proteína, o que leva à dissociação da proteína repressora da sequência O e transcrição.O isopropiltiogalactosídeo (IPTG) tem o mesmo efeito que a alolactose.É um indutor muito poderoso, que não é metabolizado por bactérias e é muito estável, por isso é muito utilizado em laboratórios.
Como determinar a concentração ideal de IPTG?Tome E. coli como exemplo.
A cepa de E. coli BL21 geneticamente modificada contendo o recombinante positivo pGEX (CGRP/msCT) foi inoculada em meio líquido LB contendo 50μg·mL-1 Amp e cultivada durante a noite a 37°C.A cultura acima foi inoculada em 10 frascos de 50mL de meio líquido LB fresco contendo 50μg·mL-1 Amp na proporção de 1:100 para cultura de expansão, e quando o valor de OD600 foi de 0,6~0,8, IPTG foi adicionado à concentração final.É 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0mmol·L-1.Após a indução na mesma temperatura e no mesmo horário, 1 mL da solução bacteriana foi retirado e as células bacterianas foram coletadas por centrifugação e submetidas a SDS-PAGE para analisar a influência de diferentes concentrações de IPTG na expressão da proteína e, em seguida, selecione a concentração de IPTG com a maior expressão de proteína.
Após experimentos, será descoberto que a concentração de IPTG não é tão grande quanto possível.Isso ocorre porque o IPTG tem uma certa toxicidade para as bactérias.Exceder a concentração também matará a célula;e de um modo geral, esperamos que quanto mais proteína solúvel expressa na célula, melhor, mas em muitos casos quando a concentração de IPTG é muito alta, uma grande quantidade de inclusão será formada.Corpo, mas a quantidade de proteína solúvel diminuiu.Portanto, a concentração de IPTG mais adequada geralmente não é quanto maior, melhor, mas quanto menor a concentração.
O objetivo da indução e cultivo de cepas geneticamente modificadas é aumentar o rendimento da proteína alvo e reduzir custos.A expressão do gene alvo não é afetada apenas pelos fatores da própria cepa e do plasmídeo de expressão, mas também por outras condições externas, como a concentração do indutor, a temperatura de indução e o tempo de indução.Portanto, em geral, antes de uma proteína desconhecida ser expressa e purificada, é melhor estudar o tempo de indução, a temperatura e a concentração de IPTG para selecionar as condições apropriadas e obter os melhores resultados experimentais.
Horário da postagem: 31 de dezembro de 2021

