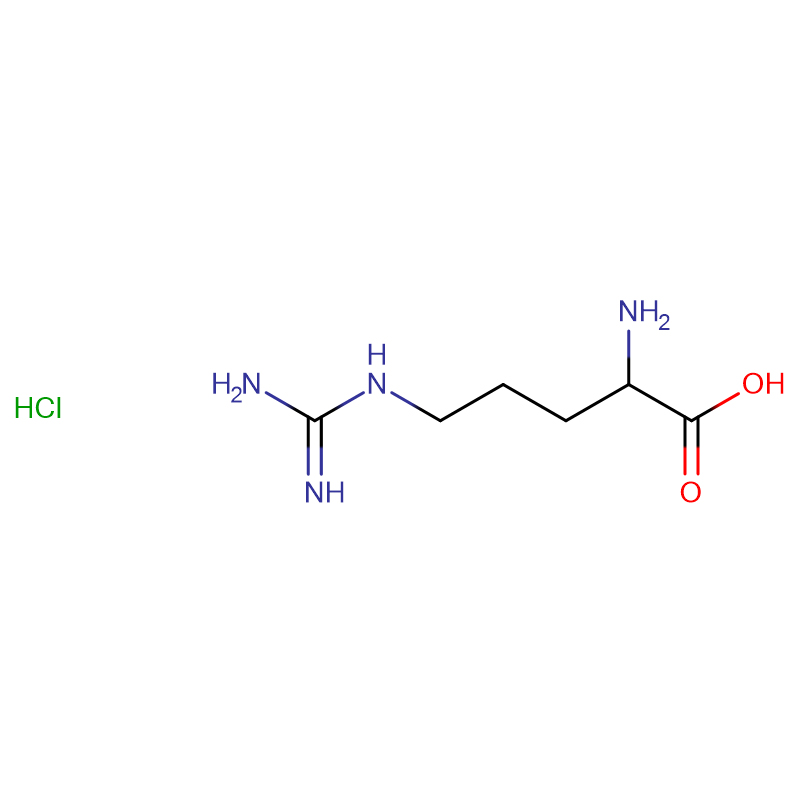
L-Arginina CAS:74-79-3 99% Cristais brancos ou pó cristalino
| Número de catálogo | XD90323 |
| Nome do Produto | L-Arginina |
| CAS | 74-79-3 |
| Fórmula molecular | C6H14N4O2 |
| Peso molecular | 174,20 |
| Detalhes de armazenamento | Ambiente |
| Código Tarifário Harmonizado | 29252900 |
Especificação do produto
| Aparência | Cristais brancos ou pó cristalino |
| Ensaio | 99% |
| Identificação | Absorção Infravermelha |
| Perda ao secar | ≤ 0,5% |
| Pureza cromatográfica | Não é encontrado mais de 0,5% de qualquer impureza individual; Não é encontrado mais de 2,0% do total de impurezas |
| Resíduo na Ignição | ≤ 0,3% |
| Metais pesados (PB) | ≤ 0,0015% |
| Ferro (como Fe) | ≤ 0,003% |
| Sulfato (como SO4) | ≤ 0,03% |
| nota usp | USP 33 |
| Cloreto (CI) | ≤ 0,05% |
| Rotação específica [ α ] D 2 5 | +26,3° ~ +27,7° |
O mecanismo de Mycobacterium smegmatis G (MbsG), uma l-lisina monooxigenase dependente de flavina, foi investigado em estado estacionário e condições de reação rápida usando efeitos de isótopos cinéticos primários e de solvente, análogos de substrato, pH e efeitos de viscosidade do solvente como sondas mecanísticas.Os resultados sugerem que a L-lisina se liga antes do NAD(P)H, o que leva a uma diminuição na constante de velocidade para redução da flavina.A ligação da l-lisina não tem efeito na taxa de oxidação da flavina, que ocorre em um processo de uma etapa sem a observação de um intermediário C4a-hidroperoxiflavina.Efeitos semelhantes foram determinados com vários análogos de substrato.A oxidação da flavina é independente do pH, enquanto os perfis de pH kcat/Km e kred/KD para NAD(P)H exibem valores únicos de pKa de ~6,0, com atividade crescente à medida que o pH diminui.Em pH mais baixo, a enzima torna-se mais desacoplada, produzindo mais peróxido de hidrogênio e superóxido.A transferência de hidreto é parcialmente limitante da velocidade em pH neutro e torna-se mais limitante da velocidade em pH baixo.Um efeito inverso da viscosidade do solvente em kcat/Km para NAD(P)H foi observado em pH neutro, enquanto um efeito de viscosidade normal do solvente foi observado em pH mais baixo.Juntos, os resultados indicam um mecanismo único onde uma mudança conformacional sensível ao pH e limitante da taxa ocorre na meia-reação redutora, que afeta a eficiência da hidroxilação da lisina.