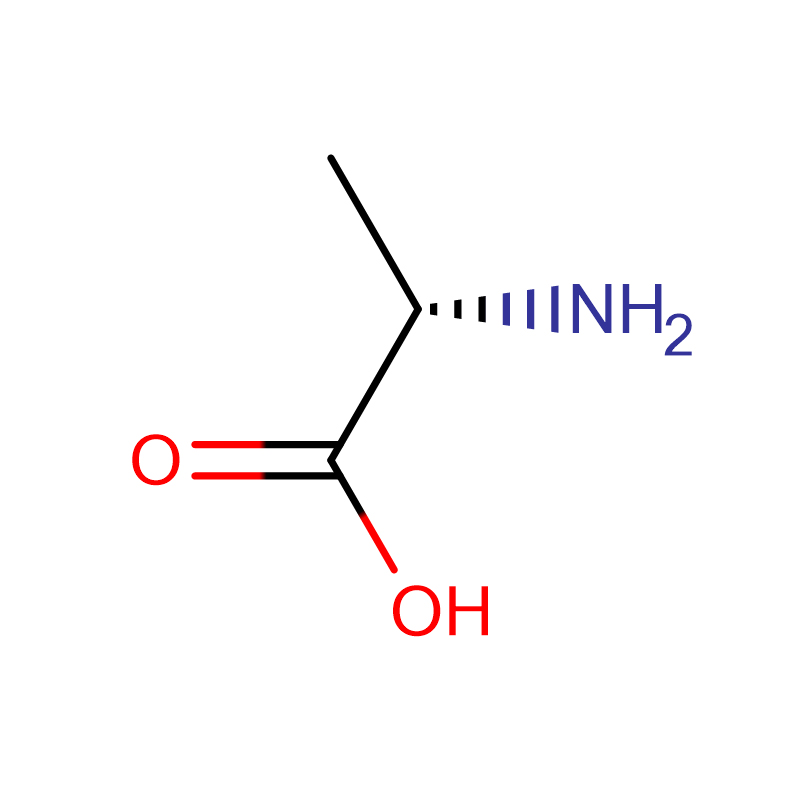
L-Alanina CAS:56-41-7 99% Pó cristalino branco
| Número de catálogo | XD90326 |
| Nome do Produto | D-Alanina |
| CAS | 338-69-2 |
| Fórmula molecular | C3H7NO2 |
| Peso molecular | 89.09 |
| Detalhes de armazenamento | Ambiente |
| Código Tarifário Harmonizado | 29224985 |
Especificação do produto
| Aparência | Pó cristalino branco |
| Ensaio | 98,5 - 101,5% |
| Rotação específica | +13,7 a +15,1 |
| Metais pesados | <0,0015% |
| pH | 5,5 - 7 |
| SO4 | <0,03% |
| Perda ao secar | <0,2% |
| Ferro | <0,003% |
| Resíduo na Ignição | <0,15% |
| Tamanho da partícula | 200um |
| Cl | <0,05% |
| Nível de poluentes orgânicos persistentes | Sem poluentes |
As γ-glutamiltranspeptidases (γ-GTs) clivam a ligação γ-glutamilamida da glutationa e transferem o grupo γ-glutamil liberado para a água (hidrólise) ou aminoácidos aceitadores (transpeptidação).Essas enzimas onipresentes desempenham um papel fundamental na biossíntese e degradação da glutationa e na desintoxicação de xenobióticos.Aqui relatamos a estrutura cristalina de resolução 3Å de Bacillus licheniformis γ-GT (BlGT) e de seu complexo com l-Glu.Estruturas de raios X confirmam que BlGT pertence à superfamília de hidrolase nucleofílica N-terminal e revelam que a proteína possui uma fenda aberta no sítio ativo semelhante à relatada para a enzima homóloga de Bacillus subtilis, mas diferente daquelas observadas para γ-GT humana e para y-GTs de outros microorganismos.Dados sugerem que a ligação de l-Glu induz um reordenamento da cauda C-terminal da subunidade grande de BlGT e permite a identificação de um agrupamento de resíduos ácidos que estão potencialmente envolvidos no reconhecimento de um íon metálico.O papel destes resíduos na estabilidade conformacional de BlGT foi estudado através da caracterização do autoprocessamento, atividade enzimática, desnaturação química e térmica de quatro novos mutantes simples de Ala.Os resultados mostram que a substituição de Asp568 por um Ala afeta tanto o autoprocessamento quanto a estabilidade estrutural da proteína.