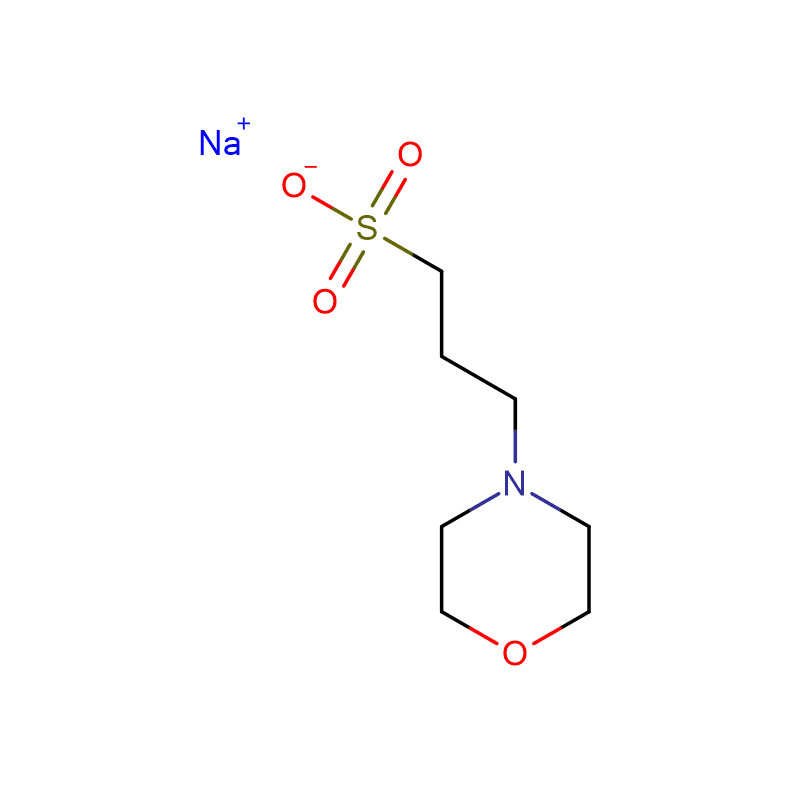
HEPBS Cas:161308-36-7 N- (2- Hidroxietil) piperazina- N'- (4-ácido butanossulfônico) Pó cristalino branco 99%
| Número de catálogo | XD90100 |
| Nome do Produto | HEPBS |
| CAS | 161308-36-7 |
| Fórmula molecular | C10H22N2O4S |
| Peso molecular | 266,36 |
| Detalhes de armazenamento | Ambiente |
| Código Tarifário Harmonizado | 2933599090 |
Especificação do produto
| Aparência | Pó cristalino branco |
| Assay | ≥ 99% |
| Temperatura de armazenamento | Loja na RT |
| Ponto de fusão | 211-216°C |
| Coeficiente de acidez (pKa) | 8.3 (a 25 ℃) |
Entendemos a importância de proteger a integridade de suas biomoléculas e reagentes com os sistemas de tamponamento corretos.Nossos tampões biológicos fornecem estabilidade de solução e controle de pH sem interferir nos processos biológicos e fornecem sais e nutrientes essenciais para células e tecidos.Nossos sistemas de tamponamento avançados podem oferecer uma estabilidade fenomenal em cultura de células, reação em cadeia da polimerase (PCR), triagem de drogas, bioprocessamento, purificação e aplicações de formulação final.Todos os nossos produtos podem ser dimensionados desde a pesquisa inicial até aplicações comerciais em vários graus de tampão.Oferecemos várias configurações de embalagem, mistura personalizada e até formulação líquida.
Também fornecemos uma seleção abrangente de bioquímicos de alta qualidade em uma variedade prática de graus e em uma variedade de opções de embalagem inovadoras e fáceis de usar.Além de produtos prontos para uso, oferecemos fabricação, mistura e embalagem de reagentes personalizados para atender às suas necessidades.
O princípio de funcionamento e o valor do pH da solução tampão Quando uma certa quantidade de ácido e álcali é adicionado a algumas soluções, tem o efeito de impedir a alteração do pH da solução, o que é chamado de efeito tampão.Tal solução é chamada de solução tampão.Soluções mistas de ácidos fracos e seus sais (como HAc e NaAc) e soluções mistas de bases fracas e seus sais (como NH3·H2O e NH4Cl) são soluções tampão.O efeito tampão da solução tampão composta pelo ácido fraco HA e seu sal NaA sobre o ácido é devido à presença de uma quantidade suficiente de álcali A- na solução.Quando uma certa quantidade de ácido forte é adicionada a esta solução, os íons H são basicamente consumidos pelos íons A-: então o pH da solução permanece quase inalterado;quando uma certa quantidade de base forte é adicionada, o ácido fraco HA presente na solução consome íons OH- que impedem a mudança de pH.



![TAPS-NA Cas:91000-53-2 Líquido 99% N-[Tris(hidroximetil)metil]-3-aminopropanossulfônico sal de sódio](http://cdn.globalso.com/xdbiochems/91000-53-2.jpg)