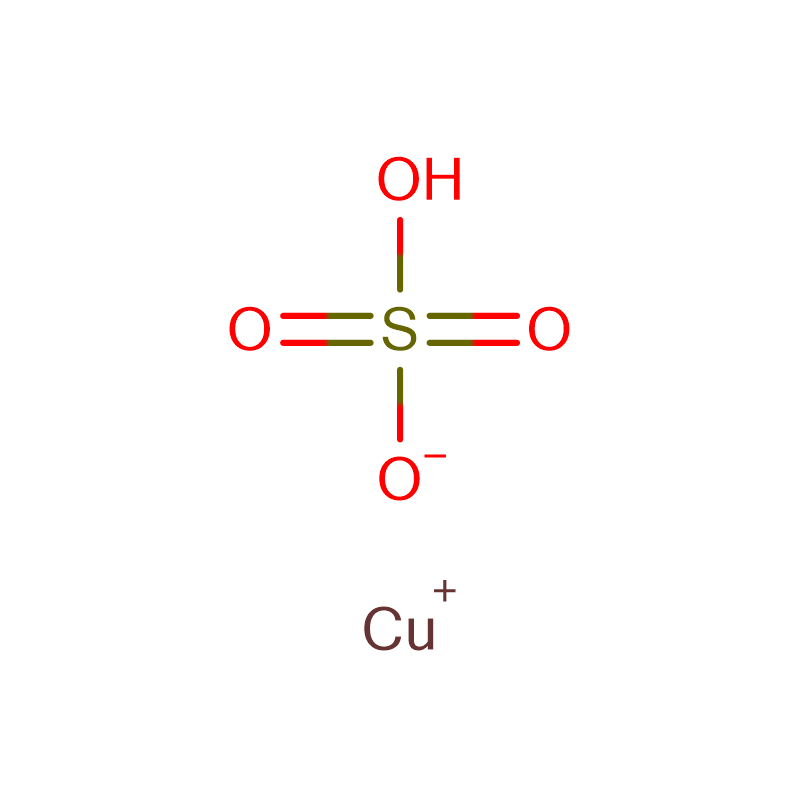
Sulfato de Cobre Penta-hidratado Cas: 7758-98-7
| Número de catálogo | XD91844 |
| Nome do Produto | Sulfato de Cobre Penta-hidratado |
| CAS | 7758-98-7 |
| Fórmula Molecularla | CuO4S |
| Peso molecular | 159,61 |
| Detalhes de armazenamento | 5-30°C |
| Código Tarifário Harmonizado | 28332500 |
Especificação do produto
| Aparência | Pó esverdeado a cinza |
| Assay | 99% min |
| Mponto final | 200 °C (dec.)(lit.) |
| densidade | 3,603 g/mL a 25 °C (lit.) |
| pressão de vapor | 7,3 mm Hg (25°C) |
| solubilidade | H2O: solúvel |
| Gravidade Específica | 3.603 |
| PH | 3,5-4,5 (50g/l, H2O, 20℃) |
| Faixa de PH | 3,7 - 4,5 |
| Solubilidade em água | 203 g/L (20 ºC) |
| Confidencial | Higroscópico |
| Estabilidade | higroscópico |
Usado como antimicrobiano e moluscicida.
O sulfato de cobre também é conhecido como vitríolo azul, essa substância foi produzida pela ação do ácido sulfúrico sobre o cobre elementar.Os cristais azuis brilhantes são solúveis em água e álcool.Misturado com amônia, o sulfato de cobre foi usado em filtros de líquidos.A aplicação mais comum para o sulfato de cobre era combiná-lo com brometo de potássio para fazer branqueamento de brometo de cobre para intensificação e tonificação.Alguns fotógrafos usaram sulfato de cobre como um retentor em reveladores de sulfato ferroso que foram usados no processo de colódio.
O sulfato de cobre é um suplemento nutricional e auxiliar de processamento mais frequentemente usado na forma de penta-hidrato.Esta forma ocorre como cristais triclínicos grandes, azuis profundos ou ultramarinos, como grânulos azuis ou como um pó azul claro.O ingrediente é preparado pela reação do ácido sulfúrico com óxido cúprico ou com cobre metálico.Pode ser usado em fórmula infantil.É também denominado sulfato cúprico.
O sulfato de cobre (II) pode ser empregado para os seguintes estudos:
Como catalisador para a acetilação de álcoois e fenóis em condições livres de solventes.
Compor o eletrólito para eletrodeposição de precursores Cu-Zn-Sn, necessários para a preparação de filmes finos Cu2ZnSnS4 (CZTS).
Como catalisador ácido de Lewis para a desidratação de álcoois.5